| |||||
|
Redoxní titrační křivka představuje závislost potenciálu elektrody na objemu přidávaného titračního činidla E = f (V) nebo na hodnotě ekvivalentového zlomku E = f(a). Pro přesné vyjádření průběhu křivky je třeba používat hodnot formálních redox potenciálů. U obecně platné redoxní reakce
 zBARed + zABOx
zBARed + zABOx
předpokládejme, že oxidovadlem (titračním činidlem) je forma AOx. Potenciál je definován Petersovou rovnicí a křivka je obrazem závislosti E = f (a), kde a = zA[AOx] / zB[BRed]. a) a = 0
E = - ∞ V
b) a < 1 Pro a = 0,5 platí E = EBf. c) a = 1 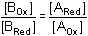
Eekv = EB = EA
zB·Eekv = zB·EfB +
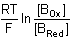
zA·Eekv = zA·EfA -
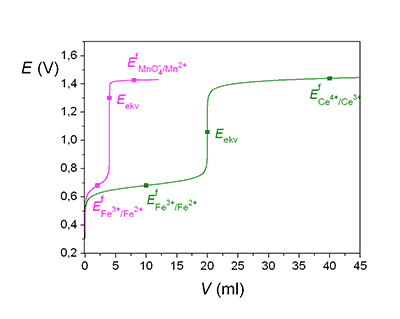
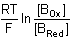 d) a > 1 Pro a = 2 platí E = EfA. Je-li zA = zB, křivka je symetrická a bod ekvivalence leží v inflexním bodě (obr. 1, zelená křivka). Je-li zA ≠ zB, křivka je nesymetrická (obr. 1, fialová křivka). Obr 1. Grafické znázornění průběhu titrace 20 ml 0,01 M-Fe2+ iontů odměrnými roztoky: a) 0,01 M-Ce(SO4)2 (zelená křivka),
b) 0,01 M-KMnO4 (fialová křivka),
v prostředí 1 M-H2SO4. EfFe3+/Fe2+
= 0,680 V, EfCe4+/Ce3+ =1,440 V,
EfMnO4-/Mn2+ = 1,426 V.
Řešené příklady:
| ||
| |||||

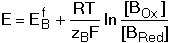
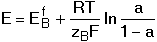
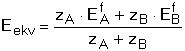
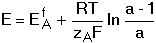
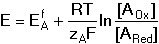 (16)
(16)