Řešení: Příklad lze řešit opět dvojím způsobem, buď podle (14a), nebo dosazením rovnovážných koncentrací do Petersovy rovnice. Objem titračního činidla potřebný pro výpočet látkové koncentrace vyplývá z definice ekvivalentového zlomku
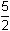 a =
a = 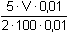
a) a = 0,1 tj. přídavek (0,1·100·2/5 = ) 4 ml 0,01M-KMnO4
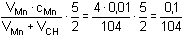 mol·l-1 mol·l-1
[H2CH] =
E = 0,699 + 0,0295 log 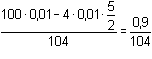 mol·l-1 mol·l-1 =
0,671 V =
0,671 V
b) a = 0,5 tj. přídavek (0,5·100·2/5 = ) 20 ml 0,01M-KMnO4
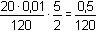 mol·l-1 mol·l-1
[H2CH] =
E = Ef = 0,699 V
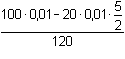 mol·l-1 mol·l-1c) a = 0,9 tj. přídavek (0,9·100·2/5 = ) 36 ml 0,01M-KMnO4
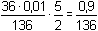 mol·l-1 mol·l-1
[H2CH] =
Dosazením do Petersovy rovnice nebo podle
(14a):
E = 0,699 + 0,0295 log 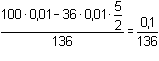 mol·l-1 mol·l-1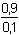 =
0,727 V =
0,727 V
d) a = 1 tj. přídavek (1·100·2/5 = ) 40 ml 0,01M-KMnO4
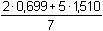 =
1,278 V =
1,278 V
e) a = 1,1 tj. přídavek (1,1·100·2/5 = ) 44 ml 0,01M-KMnO4
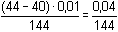 mol·l-1 mol·l-1
[Mn2+] =
E = 1,51 + 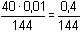 mol·l-1 mol·l-1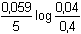 = 1,498 V = 1,498 V
Podle
(16)
je výsledek tentýž.
| ||
 C6H4(OH)2 +
2 H2O EfCH/H2CH = 0,699 V
C6H4(OH)2 +
2 H2O EfCH/H2CH = 0,699 V