Řešení: Reakce probíhá podle rovnice MnO4- + 8 H3O+ + 5 e Mn2+ + 12 H2O
Potenciál elektrody je podle
(6)
definován rovnicí Mn2+ + 12 H2O
Potenciál elektrody je podle
(6)
definován rovnicí
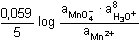
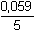 log
aH30+ = 1,510 - 0,0944 pH log
aH30+ = 1,510 - 0,0944 pH
Formální potenciál systému bude s rostoucím pH klesat lineárně, směrnice přímky bude -0,0944 V/pH. | ||