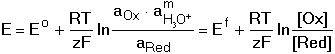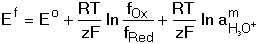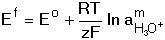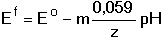| |||||
|
8.2. Vliv iontové síly a acidity roztoku na oxidačně-redukční potenciál Z Nernst-Petersovy rovnice je zřejmá závislost oxidačně-redukčního (redox) potenciálu na teplotě a na poměru aktivit obou forem redoxního páru. Poměr aktivit se však mění přítomností dalších látek v roztoku. Jejich vliv lze obsáhnout v hodnotě formálního potenciálu Ef. Formální potenciál může tedy zahrnovat i vliv iontové síly roztoku Jeho hodnota je platná pouze pro tu iontovou sílu, pro kterou byly vypočteny aktivitní koeficienty obou redoxních forem (fOx, fRed). Hodnotu potenciálu elektrody v systému redoxního páru pak vypočítáme dosazením (5) do vztahu (3) resp. (4). Hydroxoniové (resp. vodíkové) nebo hydroxidové ionty se často zúčastňují redoxní reakce. V obecném případě Ox + mH30+ + ze bude příslušný oxidačně-redukční potenciál systému závislý na pH roztoku: kde Formální potenciál v tomto případě kromě aktivitních koeficientů zahrnuje také vliv aktivity hydroxoniových iontů aH30+. V případě, že fOx = fRed, bude formální potenciál určován hodnotou pH: resp. Jeho hodnota je tedy lineární funkcí pH. Řešené příklady:
| ||
| |||||

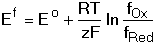
 Red
Red