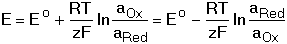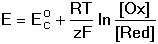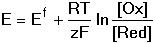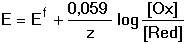| |||||
|
8.1. Oxidačně-redukční potenciály Oxidační, resp. redukční schopnost redoxního páru lze charakterizovat potenciálem, který se v elektrochemickém článku ustavuje na indikační elektrodě. Závislost tohoto rovnovážného potenciálu na aktivitách složek reakce Ox + ze vyjadřuje Nernst-Petersova rovnice kde Eo je standardní redukční potenciál a jeho hodnoty jsou tabelovány (tab. 12). Při výpočtech se často místo aktivit dosazuje koncentrace forem redoxního páru. Tyto výsledky jsou pouze přibližné. V praxi se setkáváme s potenciály definovanými "normálními" potenciály Eco a látkovými koncentracemi Při přesném měření nelze vycházet z hodnot potenciálů, které jsou vztaženy na ideální, často nerealizovatelnou soustavu poločlánků. Proto se používá tzv. "formálních" potenciálů, které jsou definovány pro vymezené reakční podmínky Po dosazení číselných hodnot za R, T, F a převedení přirozeného logaritmu na dekadický se získá upravený tvar rovnice Řešené příklady:
| ||
| |||||

 Red
Red