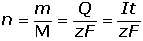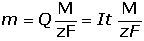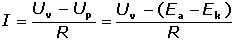| |||||
|
Sledování závislosti proudu na vloženém napětí v elektrochemickém článku, složeném z nepolarizovatelné referentní a polarizovatelné pracovní (měrné) elektrody, je předmětem voltamperometrických (pracovní elektrody s konstantním povrchem) a polarografických metod (rtuťové elektrody s obnovovaným povrchem). Připojí-li se elektrody článku k vnějšímu zdroji napětí, které bude větší než rovnovážné (Uv > Ur), začne na kladné elektrodě (anodě) probíhat oxidační reakce a uvolněné elektrony se budou spotřebovávat na záporné katodě k redukci, tzn., že proud bude protékat článkem opačným směrem než v případě článku galvanického. Podle Faradayových zákonů je látkové množství n, které podlehlo elektrolýze, určeno vztahem resp. kde m je hmotnost látky, M – molární hmotnost analytu, Q – náboj, I – proud, t – čas, z – počet elektronů vyměněných při reakci, F – Faradyova konstanta (F = 96500 C·mol-1, přesněji 96485,34 C·mol-1)
Potenciálový rozdíl anody a katody – polarizační napětí Up – působí proti napětí vloženému Uv. Velikost proudu se pak řídí rozšířeným Ohmovým zákonem Pokud I < 1·10–4 A a odpor článku klesne na jednotky, příp. desítky ohmů, lze napětí
IR zanedbat a platí | ||
| |||||