| |||||
|
Membránové elektrody jsou v praxi nejrozšířenějšími potenciometrickými elektrodami. Skládají se z iontově selektivní membrány, vnitřního elektrolytu a vnitřní referentní elektrody nebo z iontově selektivní membrány a pevného kontaktu (tzv. solid-state elektrody).
Základní rozdíl mezi membránovými a kovovými elektrodami spočívá v charakteru reakce, která probíhá na mezifází elektroda/roztok. U iontově selektivní membrány nedochází na povrchu k ustavení redoxní rovnováhy, ale rovnováhy výměnné. Iontově selektivní membrána obsahuje ionty Xz+, které se mohou vyměňovat za ionty z roztoku (v ideálním případě pouze za ionty Xz+) v závislosti na jejich aktivitách aXz+ v obou fázích. Jestliže např. aktivita iontů Xz+ v roztoku bude menší než v membráně, budou ionty z membrány difundovat do roztoku. Tím vznikne v roztoku těsně u membrány přebytek kladných nábojů, který zabrání další difúzi iontů z membrány – ustaví se rovnováha. Důsledkem různých nábojů v povrchové vrstvě membrány a v roztoku těsně u membrány je vznik elektrického potenciálu Φ na rozhraní roztok/membrána. V běžných iontově selektivních elektrodách (ISE) membrána odděluje dva roztoky obsahující ion Xz+: vnější, analyzovaný roztok (1) a vnitřní roztok (2), jehož složení je stálé. Na každé straně membrány vznikají odpovídající potenciály Φ1 a Φ2. Rozdíl těchto potenciálů je tzv. membránový potenciál Em (pro 25 °C):
V ideálním případě je iontově selektivní membrána schopna s roztokem vyměňovat pouze jediný druh iontů Xz. Avšak reálné membrány se nechovají ideálně a jsou schopny do určité míry interagovat i s jinými, interferujícími ionty (Bm). Membránový potenciál je pak definován vztahem (Nikolského-Eisenmanova rovnice):
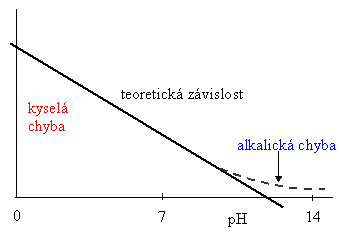
kde + platí pro membránu vyměňující kationty, - se vztahuje k aniontovým elektrodám a kX,B je koeficient selektivity vyjadřující poměr odezvy elektrody na interferující ion Bm ku odezvě na analyzovaný ion Xz. Je-li např. kX,B = 103, pak příspěvek iontu Bm k membránovému potenciálu je 1000 krát větší než příspěvek analyzovaného iontu Xz. Membrány použitelné v ISE musí být ve vodě nerozpustné a zároveň musí vykazovat určitou iontovou vodivost, aby měřicí elektrický obvod byl uzavřen. Vodivost zajišťují volné ionty (vyměňované s roztokem nebo i jiné) v objemu membrány. Iontově selektivní membrány se dělí na: a) skleněné membrány, tvořené trojrozměrnou sítí křemičitanových skupin, jejichž záporný náboj kompenzují volně pohyblivé kationty (Na+, K+, Ca2+, Li+, atd.). Složení skla určuje selektivitu vůči různým iontům. Skleněná elektroda pro měření pH je nejstarší a nejpoužívanější ISE. Iontově selektivní membránou je tenká vrstvička skla (asi 0,1 mm), která ve vodě vytváří na povrchu hydratovanou vrstvu, v níž jsou sodné ionty ze skla nahrazeny hydroxoniovými ionty z roztoku. Po určité době máčení (podle druhu skla několik hodin, den až několik dní) se ustaví rovnovážný stav a hydratovaná vrstva (tloušťky několika desítek nanometrů) působí jako měnič iontů: Na+(sklo) + H3O+(aq) Důsledkem této výměnné reakce, která probíhá na vnitřní i vnější straně skleněné membrány, je vznik membránového potenciálu závislého na pH měřeného roztoku podle rovnice (pro 25 °C): Em = K + Easym + 0,059 log aH3O+ = K' - 0,059 pH kde Easym je tzv. asymetrický potenciál vznikající v důsledku toho, že vnější a vnitřní strana skleněné membrány nejsou zcela stejné, tj. při stejných aktivitách vodíkových iontů vnitřního i analyzovaného roztoku není membránový potenciál roven nule. Hodnota asymetrického potenciálu se kompenzuje při kalibraci skleněné elektrody. Teoretická závislost potenciálu skleněné elektrody na pH je tedy přímková se směrnicí –0,059 mV/pH . Odchylka od linearity (tzv. alkalická chyba) se projevuje v silně alkalických roztocích (pH > 11), kde aktivita iontů alkalických kovů mnohonásobně převyšuje aktivitu vodíkových iontů. V hydratované vrstvě probíhá částečně i výměnná reakce opačného směru a rovnovážná aktivita iontů H3O+ na povrchu membrány neodpovídá jejich skutečné aktivitě v roztoku. Pro měření v alkalické oblasti (až k hodnotám kolem pH 14) lze použít elektrod zhotovených ze speciálních rezistentnějších druhů skel, v nichž je sodík nahrazen lithiem, cesiem nebo rubidiem a vápník částečně stronciem, baryem, příp. lanthanem. V kyselých roztocích (pH < 1) je odklon od linearity způsoben tzv. kyselou chybou. Její příčiny jsou méně jasné, připisují se změnám obsahu vody v hydratované vrstvě gelovité kyseliny křemičité na povrchu membrány. Do této vrstvy proniká velké množství vodíkových iontů, čímž se mění jejich aktivita v membráně.
b) krystalické membrány, tvořené buď monokrystalem vhodné látky nebo membránou lisovanou z polykrystalického materiálu. Typickým představitelem monokrystalických membrán je monokrystal fluoridu lanthanitého, LaF3, který je používán v ISE pro stanovování fluoridových iontů. Fluoridová ISE je druhou nejspolehlivější iontově selektivní elektrodou po skleněné elektrodě. Její membrána je tvořena monokrystalem LaF3 s malou příměsí EuF2, který zvyšuje vodivost membrány. Monokrystal LaF3 je zataven do trubičky z nevodivého materiálu (speciální epoxidová pryskyřice) naplněné standardním roztokem fluoridových iontů (obvykle 0,1 M-NaF) a obsahující vnitřní referentní argenchloridovou elektrodou. Membránový potenciál vzniká v důsledku různé rozpustnosti LaF3 na obou stranách membrány. Měřený rovnovážný potenciál se mění s aktivitou fluoridových iontů aF- v analyzovaném roztoku: ΔE = K - 0,059 log aF- Stanovení fluoridů je velmi selektivní. Jediným interferujícím iontem je OH- (koeficient selektivity kF-,OH- = 0,1). Aby interference byla co nejmenší, je nutné při měření udržovat pH optimálně kolem hodnoty 5,6.
Polykrystalické membrány jsou lisovány z málo rozpustných solí těžkých kovů, velmi často sulfidů. Např. jodidová ISE je tvořena polykrystalickou směsí AgI a Ag2S, který zvyšuje iontovou vodivost membrány. Dalšími běžnými polykrystalickými elektrodami jsou např. bromidová, sulfidová, měděná, olověná a kadmiová ISE.
c) kapalné membrány tvořené ve vodě nerozpustnou aktivní složkou (zodpovědnou za iontovou výměnu). Nejčastěji se aktivní složka imobilizuje v tuhém polymeru. Typickým polymerem používaným k přípravě membrány je polyvinylchlorid (PVC) obsahující změkčovadlo (plastifikátor), které bývá zároveň hydrofobním rozpouštědlem aktivní složky membrány. Aktivními složkami membrány mohou být buď iontoměniče tvořící se stanovovaným iontem iontový asociát (např. dusičnan tridodecylmethylamonný v dusičnanové ISE), nebo ionofory tvořící se stanovovaným iontem komplex (např. valinomycin v draslíkové ISE).
| ||


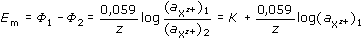
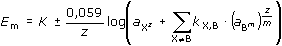
 Na+(aq) + H3O+(sklo)
Na+(aq) + H3O+(sklo)