|
- Příklad IV.4.17



- Koncentrace vápenatých iontů ve vzorku vody byla stanovena Ca2+-ISE metodou kalibrační křivky.
Kalibrační roztoky byly připraveny ředěním zásobního roztoku 0,1M-Ca2+ do 50 ml odměrných baněk
a iontová síla roztoků byla upravena přídavkem roztoku KNO3 tak, aby jeho celková koncentrace
v roztoku byla 0,5 mol/l (např. 5 ml 5M-KNO3). Objem 40 ml vzorku vody byl odměřen do 50 ml
odměrné baňky a doplněn roztokem KNO3 pro úpravu iontové síly a destilovanou vodou stejně
jako kalibrační roztoky. Hodnoty rovnovážného napětí článku s Ca2+-ISE a SCE naměřené
v kalibračních roztocích a ve vzorku vody jsou v tabulce:
| [Ca2+] (mol/l) | E (mV)
|
|---|
| 1·10-5 | -0,125
| | 5·10-5 | -0,103
| | 1·10-4 | -0,093
| | 5·10-4 | -0,072
| | 1·10-3 | -0,065
| | 5·10-3 | -0,043
| | 1·10-2 | -0,033
| | vzorek | -0,084
|
Určete koncentraci iontů Ca2+ ve vodě.
Řešení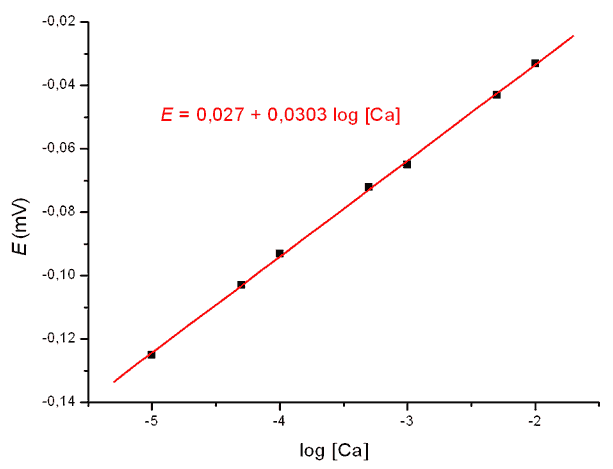
Lineární regresí se získá rovnice kalibrační závislosti (obr): E = 0,027 + 0,0303 log [Ca2+]Dosazením potenciálu změřeného v roztoku vzorku obdržíme pro koncentraci vápenatých iontů: log [Ca2+] = (-0,084 - 0,027) / 0,0303 = = -3,6634[Ca2+] = 10-3,66 = 2,17·10-4 mol·l-1 Vzhledem ke zředění vzorku vody (40 ml vzorku analyzované vody do 50 ml odměrky) je výsledná koncentrace vápenatých iontů ve vodě 2,71·10-4 mol·l-1, tj. 10,88 mg·l-1. Zpět
|
|