|
- Příklad IV.4.6




- Článek, složený z nasycené kalomelové elektrody (kladný pól) a vodíkové elektrody sycené vodíkem
za parciálního tlaku 100,001 kPa a ponořené do roztoku slabé jednosytné kyseliny
(KHA = 3,2·10–4,, t = 25 °C), má napětí
Ue = 0,483 V. Z kolika procent je kyselina zneutralizována?
ESKE = 0,241 V, pH2O = 3,20 kPa
ŘešeníGrafický rozbor zadání: 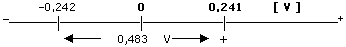
Ue = 0,241 - EH = 0,241 - 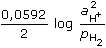 = 0,483 V = 0,483 V EH = (-0,483 + 0,241) = -0,242 V = 0,0592 log aH+ - 0,0296 log pH2 EH = –0,242 = 0,0592 log aH+ - 0,0296 log 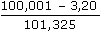 EH = –0,242 = 0,0592 log aH+ - 5,9·10-4 ≈ 0,0592 log aH+ log aH+ = -4,0878 aH+ = 8,17·10-5 mol·l-1 Protože [HA](%) + [A–1](%) = cHA(100%), lze dosazením do disociační konstanty kyseliny vypočítat procentový obsah jednotlivých složek systému: KHA = 3,2·10-4 = 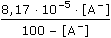  3,2·10-2 = 4,017·10-4 [A-] 3,2·10-2 = 4,017·10-4 [A-] [A-] = 79,66 % resp. EH = –0,242 = –0,0592 pH  pH = 4,088 pH = 4,088 pH = pKHA + log 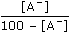  [A-] = 79,92 % [A-] = 79,92 % Zpět
|
|