- Příklad VI.2.10




- Při elektrolýze zředěného roztoku kyseliny sírové se konstantním proudem 1 A vyloučilo 600 ml plynů
(H2 a O2 za standardních podmínek).
a) Jaké množství vody (v gramech) se elektrolýzou rozložilo?
b) Jakou dobu trvala elektrolýza?
Mr(H2O) = 18,01
Řešenía) Mechanismus rozkladu vody: katodický děj: 2H+ + 2e– → H2 anodický děj: H2O → ½ O2 + 2H+ + 2e–
látková množství složek: nH2O → nH2 + ½ nO2 1 mol H2 ...... 22414 ml ½ mol O2 ..... 11207 ml
33621 ml plynu vznikne z 18,01 g (= 1 mol) H2O 600 ml ...... m
m = 0,3214 g H2O b) t = 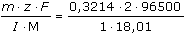 = 3444 s = 57,40 min = 57min 24s = 3444 s = 57,40 min = 57min 24s Zpět
|