|
- Příklad VI.2.12




- Žárovka je zapojena na baterii složenou ze 3 LeClanchéových suchých článků spojených za sebou. Baterie
pracuje denně 15 minut. Jaké množství zinku a chloridu amonného se v těchto článcích spotřebuje za 2
týdny, protéká-li proud 0,2 A?
Mr(NH4Cl) = 53,49; Mr(Zn) = 65,37
Mechanismus reakce: Zn + 2NH4+ → Zn2+ + H2 + 2NH3
2MnO2 + H2 → Mn2O3 + H2O
Zinečnaté ionty s amoniakem tvoří ionty Zn(NH3)22+, které se vylučují
ve formě krystalů Zn(NH3)2Cl2.
Řešenía) mZn = 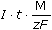 · 3 = 0,2 · 900 · 14 · · 3 = 0,2 · 900 · 14 · 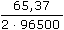 · 3 = 2,56 g · 3 = 2,56 g mNH4Cl = 0,2 · 900 · 14 · 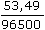 · 3 = 4,19 g · 3 = 4,19 g b) Poměr látkových množství zinku a chloridu amonného: n(Zn) : 2n (NH4Cl) 65,37 g Zn ..... 2·53,49 g NH4Cl 2,56 g ........ m
m = 4,19 g NH4Cl Zpět
|
|