|
- Příklad VI.2.27




- Vzorek 2,18 mg technického oxidu arsenitého byl rozpuštěn v 0,1M-NaOH a po následném okyselení zředěnou
HCl byl doplněn vodou na objem 100 ml. Podíl 20 ml byl převeden do coulometrické nádobky a přidán bromid
sodný. Titrace anodicky generovaným bromem byla provedena ve 4 stejných objemových podílech, sledována
byla potenciometricky, čas měřen stopkami. Při proudu 5 mA probíhala chemická reakce v jednotlivých
podílech 167,3 – 164,2 – 168,2 – 166,4 vteřin. Jaký je procentuální (průměrný) obsah
As2O3 ve vzorku? Mr(As2O3) = 197,82
ŘešeníV případě As2O3 je oxidace bromem 4-elektronová, tedy m1 = 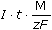 = 5 · 167,3 · = 5 · 167,3 · 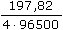 = 0,4287 mg = 0,4287 mg Stanovení v dalších podílech: t2-4: 164,2 s 168,2 s 166,4 s m2-4: 0,4210 mg 0,4310 mg 0,4264 mg Průměr výsledků:  1-4 = 0,4268 mg 1-4 = 0,4268 mg Procentový obsah: wAs2O3 = 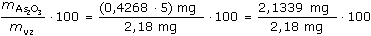 = 97,88% = 97,88% Zpět
|
|