|
- Příklad VI.2.31




- Roztok bromidu sodného má pH 6,5. Po přídavku 25,00 ml HCl se elektrolyzuje (titruje) při proudu 0,006 A
po dobu 500 vteřin, kdy pH-metr ukazuje opět hodnotu pH 6,5. Elektrody: Pt-katoda a Ag-anoda. Jaká je
látková koncentrace přidané kyseliny chlorovodíkové a jaký objem vodíku (při standardních podmínek)
se vytvořil během titrace za předpokladu 100% proudové účinnosti? Mr(HCl) = 36,45,
Mr(H) = 1,008
ŘešeníVýpočet koncentrace kyseliny ze vztahu (VI.9): m = 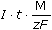  n = c · V = n = c · V = 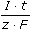 mHCl = 0,006 · 500 · 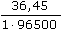 = 1,133·10-3 g = 1,133·10-3 g cHCl = 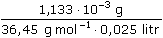 = 1,24·10-3 mol·l-1 = 1,24·10-3 mol·l-1 resp. cHCl = 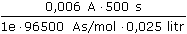 = 1,24·10-3 mol·l-1 (As = C) = 1,24·10-3 mol·l-1 (As = C) b) Výpočet objemu vzniklého vodíku: mH = 0,006 · 500 · 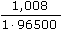 = 3,134·10-5 g = 3,134·10-5 g Protože specifický molární objem plynu je Vo = 22,414 litru, množství mH vodíku představuje objem VH = n · Vo = 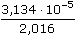 · 22,414 = 3,48·10-4 litru ≈ 0,35 ml · 22,414 = 3,48·10-4 litru ≈ 0,35 ml Zpět
|
|




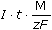
 n = c · V =
n = c · V = 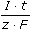
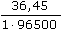 = 1,133·10-3 g
= 1,133·10-3 g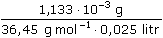 =
= 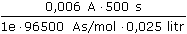 =
= 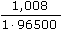 = 3,134·10-5 g
= 3,134·10-5 g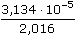 · 22,414 = 3,48·10-4 litru ≈
· 22,414 = 3,48·10-4 litru ≈