- Příklad VI.2.36




- Objem 10 ml 0,01M-Fe2+ byl oxidován generovaným chlorem. Generační proud 20 mA protékal
6 minut. Jaké bude EMN článku v této fázi titrace? Indikace průběhu redoxní reakce byla sledována
potenciometricky (Pt-SCE). ESKE = 0,241 V
ŘešeníSchéma chemické redoxní reakce: 2 Fe2+ + Cl2 → 2 Fe3+ + 2 Cl–  n(Fe3+) = n(Cl2) · 2 n(Fe3+) = n(Cl2) · 2 Výpočet látkových množství a koncentrací složek: n(Cl2) = 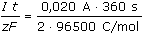 = 3,73·10-5 mol = 3,73·10-5 mol n(Fe3+) = n(Cl2) · 2 = 7,46·10-5 mol [Fe3+] = 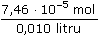 = 7,46·10-3 mol/l = 7,46·10-3 mol/l n(Fe2+)pův. = 0,010 · 0,01 = 1·10-4 mol n(Fe2+)nezreag. = n(Fe2+)pův. - n(Fe3+) = (1·10-4 - 7,46·10-5) mol = 2,54·10-5 mol [Fe2+]nezreag. = 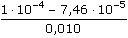 = 2,54·10-3 mol/l = 2,54·10-3 mol/l Výpočet potenciálu indikační elektrody využitím koncentrací Fe3+,2+ (příp. látkových množství) a EMN článku: EFe = 0,771 + 0,0592 log 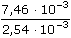 = 0,771 + 0,028 = 0,799 V = 0,771 + 0,028 = 0,799 V Ue = E+ - E- = 0,799 - 0,241 = 0,558 V Zpět
|