- Příklad VI.2.37




- Vzorek 0,2460 g jednosytné organické kyseliny byl rozpuštěn a doplněn na objem 100 ml. Podíl 10 ml byl
přenesen do coulometrické nádobky a do bodu ekvivalence (486 vteřin) neutralizován ionty OH–
generovanými na Pt-katodě z vody konstantním proudem 0,04 A. Jaká je molární hmotnost kyseliny?
ŘešeníMechanismus generace titrantu (OH–): 2 H2O + 2 e → H2 + 2 OH–  1 OH– odpovídá 1 e– 1 OH– odpovídá 1 e– Výpočet látkového množství kyseliny vychází z předpokladu: nHA = nOH- nHA = 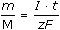  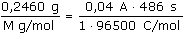 · 10 = 2,0145·10-3 mol · 10 = 2,0145·10-3 mol M = m / nHA = 0,2460 g / 2,0145·10–3 mol = 122,11 g·mol-1 Zpět
|