|
- Příklad VI.2.5




- Jaký objem kyslíku se uvolní z roztoku NaOH proudem 2A, který prochází článkem 1,5 hodiny? t = 27 °C,
p = 101,325 kPa
Děj na katodě: Na+ + e → Na  2 Na + H2O = 2 NaOH + H2 2 Na + H2O = 2 NaOH + H2
Děj na anodě: 4 OH– – 4e  2 H2O + O2 2 H2O + O2
ŘešeníLátkové množství kyslíku: nO2= 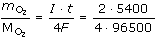 = 0,02798 mol = 0,02798 mol a) Specifický molární objem plynu: Vo = 0,022414 m3/mol při 273,15 K (= 0 °C) a normálního tlaku 101,325 kPa 1 mol .............. 22,41 litru 0,02798 mol .... V
V0°C = 0,627 litru V27°C = 0,0627 · 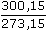 = 0,689 litru = 0,689 litru b) Výpočet na základě stavové rovnice plynů (p = 1,01325·105 Pa, T = 300,15 K): pV = nO2RT (R = 8,3144 JK–1mol–1) V = 0,02798 · 8,3144 · 300,15 / 1,01325·105 = 6,8878·10–4 m3, tj. 0,689 litru Zpět
|
|