|
- Příklad 2.14




- Jaký objem hydroxidu amonného s obsahem 2,5%(m/m) NH3
(ρ = 0,9890 g·cm-3) je třeba na vysrážení hydroxidu železitého
ze vzorku rudy o hmotnosti 0,5263 g, obsahující 12%(m/m) železa?
Řešení Z rovniceFe3+ + 3 NH3 + 3 H2O → Fe(OH)3 + 3 NH4+ vyplývá, že na vysrážení 1 molu Fe jsou třeba 3 moly NH3, a tedy na 55,85 g Fe by bylo třeba 3 · 17,03 = 51,09 g NH3.Vzorek 0,5263 g rudy obsahuje 12% Fe, což je 0,06316 g Fe. Na toto množství Fe by bylo třeba: 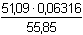 = 0,05778 g NH3 (s hmotnostním obsahem 100%). = 0,05778 g NH3 (s hmotnostním obsahem 100%).
Nepřímou úměrou zjistíme potřebnou hmotnost roztoku s 2,5% NH3:m = 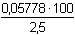 = 2,3111 g = 2,3111 g Potřebný objem se vypočítá pomocí hustoty:V = 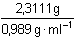 = 2,3368 ml ≈ 2,34 ml = 2,3368 ml ≈ 2,34 ml Zpět
|
|