|
- Příklad 2.28



- Vzorek živce o hmotnosti 0,5000 g byl převeden na směs chloridů o hmotnosti
0,1180 g. Následující reakcí s roztokem dusičnanu stříbrného bylo získáno 0,2451 g
AgCl. Jaký je hmotnostní obsah Na2O a K2O ve vzorku?
Rada Ze zadání vyplývá:m(NaCl) + m(KCl) = 0,1180 gm(AgCl)NaCl + m(AgCl)KCl = 0,2451 g Z jednoduchých reakčních schémat2 NaCl → 2 AgCl → Na2O2 KCl → 2 AgCl → K2O vyplývají vzájemné vztahy látkových množství vyvážek a stanovovaných složek:n(NaCl) = n(AgCl) = n(Na2O) · 2 resp. n(KCl) = n(AgCl) = n(K2O) · 2 Dosazením hmotností za látková množství se získají vztahy: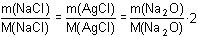 resp. resp. 
Matematickou úpravou lze vyjádřit hmotnosti jednotlivých chloridů:m(NaCl) = 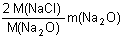 resp. m(KCl) = resp. m(KCl) = 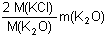 m(AgCl) = 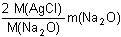 resp. m(AgCl) = 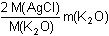 Dosazením těchto vztahů do původnich rovnic, získáme soustavu rovnic o dvou neznámých (m(Na2O), m(K2O)).--- Příklad lze řešit také tím způsobem, že ze soustavy dvou rovnic o dvou neznámých [m(NaCl) a m(KCl)] se vypočítají hmotnosti obou chloridů a následně se převedou na hmotnosti, resp. procentuality oxidů. Zpět
|
|