| |
| |
- Příklad 2.30



- Směs oxidů Fe2O3 a Al2O3 měla hmotnost 0,7100 g.
Žíháním v proudu vodíku byl oxid železitý zredukován na kovové železo. Výsledná směs měla
hmotnost 0,6318 g. Jaký je procentový obsah hliníku v původní směsi?
Rada Lze řešit pomocí soustavy rovnic: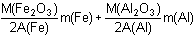 = 0,71 g = 0,71 gm(Fe) + 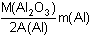 = 0,6318 g
nebo na základě úvahy:Rozdíl vyvážek před a po redukci odpovídá množství kyslíku obsaženého v Fe2O3:;3 moly O jsou obsaženy v 1 mol Fe2O3, tedy 3 · 16 g O .........................159,69 g Fe2O30,71 – 0,6318 g O ............ m(Fe2O3)
Z rozdílu hmotnosti směsi oxidů a hmotnosti Fe2O3 se pak snadno spočítá obsah Al2O3 ve směsi a z něho pak procentový obsah hliníku. Zpět
|
| | |
|
|