|
- Příklad 3.10
- Odváženo bylo 5,0312 g olea a zředěno vodou na objem 250 ml. Na
neutralizaci 10 ml tohoto roztoku bylo spotřebováno 48,52 ml 0,09103M-KOH.
Jaký je hmotnostní obsah volného SO3 ve vzorku olea?
Mr(SO3) = 80,06; Mr(H2SO4) = 98,08;
Mr(H2O) = 18,02.
Řešení:
Celkové množství SO 3 zjištěné titrací a vypočítané podle
(2),
resp. (3):
m(SO3) = 48,52 · 0,09103 · 1/2 ·80,06 · 25 = 4420,09 mg
w(SO3) = 87,85%
Množství vody sloučené s SO3 na kyselinu:
m(H2O) = 5,0312 – 4,4201 = 0,6111 g
Množství SO3 vázaného na vodu:
m(SO3)váz. = 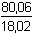 · 0,6111 = 2,7150 g
· 0,6111 = 2,7150 g
w(SO3)váz. = 53,96%
Množství volného SO3 v oleu:
a)
m(H2SO4) = 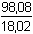 · 0,6111 =3,3261 g
· 0,6111 =3,3261 g
m(SO3)vol. = moleum - mkyselina
= 5,0312 - 3,3261 = 1,7051 g
w(SO3)vol. = 33,89%
b)
m(SO3)vol. = m(SO3)celk. - m(SO3)váz.
= 4,4201 - 2,7150 = 1,7051 g
w(SO3)vol. = 33,89% ..... (87,85% - 53,96% =
33,89%)
Hmotnostní (procentový) obsah volného SO3 v oleu je 33,89%.
Zpět
|
|
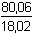 · 0,6111 = 2,7150 g
· 0,6111 = 2,7150 g
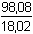 · 0,6111 =3,3261 g
· 0,6111 =3,3261 g