|
- Příklad 3.104




- Směs ZrO2 a HfO2 hmotnosti 50 mg byla digerováním s kyselinou
seleničitou převedena na seleničitany. Po jejich izolaci byla z nich minerální kyselinou
uvolněna kyselina seleničitá a zredukována jodidem na selen. Vzniklý jod byl ztitrován
22,06 ml 0,11052M-Na2S2O3. Jaký je hmotnostní obsah
jednotlivých oxidů ve směsi?
Řešení Látková množství reagentů jsou v následujícím vztahu: n(ZrO2) = n(H2SeO3) · 1/2n(H2SeO3) = n(I2) · 1/2 n(I2) = n(S2O32-) · 1/2 Vzájemný poměr reagentů: n(ZrO2) : n(H2SeO3) : n(I2) : n(S2O32-) = 1:2:4:8 Řešení pomocí soustavy dvou rovnic o dvou neznámých:m(ZrO2) + m(HfO2) = 50 mg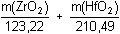 = 22,06 · 0,11052 · 1/8 mmol
m(ZrO2) = 19,977 mg  w(ZrO2) = 39,95 % w(ZrO2) = 39,95 %m(HfO 2) = 30,023 mg  w(HfO 2) = 60,05 % Zpět
|
|