| |
| |
- Příklad 3.68




- Navážka 0,5000 g směsi LiCl a BaCl2·2H2O byla rozpuštěna
a vysrážena 50,00 ml 0,1738M-AgNO3. Po oddělení sraženiny byl přebytek
Ag+-iontů vytitrován roztokem 0,1088M-KSCN. Jaký je hmotnostní obsah jednotlivých
chloridů ve směsi, byla-li spotřeba titrantu 22,50 ml?
Řešení n(AgNO3)váz. = 50,00 · 0,1738 – 22,50 · 0,1088 ·1 = 6,242 mmolSoustava dvou rovnic: m(LiCl) + m(BaCl2) = 0,5000 g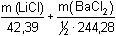 = 6,242·10 -3 mol Výsledky:m(LiCl) = 0,1395 g  (w) = 27,90 % LiCl (w) = 27,90 % LiClm(BaCl2) = 0,3605 g  (w) = 72,10 % BaCl2 (w) = 72,10 % BaCl2 Zpět
|
| | |
|
|