| |
| |
- Příklad 3.69




- Při analýze silikátu hmotnosti 0,800 g bylo vyizolováno 0,2400 g směsi NaCl + KCl.
Po rozpuštění chloridů bylo přidáno 50,00 ml 0,1211M-AgNO3 a přebytek byl
ztitrován 14,46 ml KSCN koncentrace 0,15743 mol·l-1.
Jaký je hmotnostní obsah Na2O a K2O v silikátu?
Řešení n(AgNO3)váz. = 50,00 · 0,1211 – 14,46 · 0,15743 · 1 = 3,7786 mmolSoustava dvou rovnic: m(NaCl) + m(KCl) = 240 mg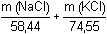 = 3,7786 mmol Výsledky:m(NaCl) = 151,25 mgm(KCl) = 88,75 mg Převod na oxidy:n(Na2O) = n(NaCl) · 1/2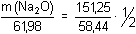  m(Na 2O) = 80,206 mg Analogicky pro K2O:n(K2O) = n(KCl) · 1/2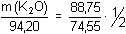  m(K 2O) = 56,07 mg --- Pozn.: řešení je možné také dosazením oxidů (jako neznámých veličin) za příslušné chloridy v soustavě rovnic, neboť platí: n(M2O) = n(MCl) · 1/2Zpět
|
| | |
|
|