|
- Příklad 3.77
- Ze vzorku hmotnosti 0,1121 g byl hořčík vysrážen jako 8-hydroxychinolát
hořečnatý. Po izolaci sraženiny, jejím následném rozpuštění v minerální kyselině a po
přídavku KBr byla organická složka ("oxin") stanovena odměrným roztokem
bromičnanu. Jaký je hmotnostní obsah hořčíku ve vzorku, spotřebovalo-li se k titraci
12,20 ml 0,0500M-KBrO3? Ar(Mg) = 24,30.
Řešení:
Reakční mechanismus je následující:
2 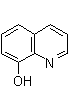 + Mg2+ →
2 + Mg2+ →
2 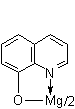 + 2 H+ + 2 H+
BrO3- + 5 Br- + 6 H3O+ →
3 Br2 + 9 H2O
 + 2 Br2 → + 2 Br2 →
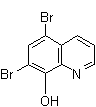 + 2 HBr + 2 HBr
Pro stechiometrické poměry reakčních složek platí
Mg2+  Mg(oxin)2 Mg(oxin)2
 2 oxin 2 oxin  8 Br
8 Br  4 Br2 4 Br2
[Mg 2+] : [Br] = 1:8 [Br] : [BrO 3- ] = 6:1
 [Mg 2+] : 6[BrO 3- ] = 1:8
resp.
[Mg2+] : [Br2] = 1:4 [Br2] : [BrO3- ] = 3:1
 [Mg2+] : 3[BrO3- ] = 1:4 [Mg2+] : 3[BrO3- ] = 1:4
Látková množství budou ve vzájemném vztahu podle
(1)
n(Mg2+) = n(BrO3-) · 6/8 = n(BrO3-) · 3/4
Hmotnostní obsah hořčíku ve vzorku bude podle
(3)
w(Mg) = 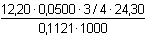 = 0,09917 .....
9,92 % = 0,09917 .....
9,92 %
Zpět
|
|
 + Mg2+ →
2
+ Mg2+ →
2  + 2 H+
+ 2 H+
 + 2 Br2 →
+ 2 Br2 →
 + 2 HBr
+ 2 HBr
 Mg(oxin)2
Mg(oxin)2
 2 oxin
2 oxin  8 Br
8 Br  4 Br2
4 Br2
 [Mg2+] : 6[BrO3- ] = 1:8
[Mg2+] : 6[BrO3- ] = 1:8
 [Mg2+] : 3[BrO3- ] = 1:4
[Mg2+] : 3[BrO3- ] = 1:4
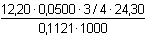 = 0,09917 .....
9,92 %
= 0,09917 .....
9,92 %