|
- Příklad 3.80
- Vzorek roztoku kyseliny siřičité a sírové hmotnosti 0,2000 g spotřeboval při
alkalimetrické titraci na methylovou oranž 16,20 ml 0,1100M-NaOH. Při
jodometrické titraci téže navážky vzorku se spotřebovalo 4,66 ml 0,06065 molárního
roztoku jodu. Jaký je procentový obsah jednotlivých kyselin ve vzorku?
Mr(H2SO4) = 98,08;
Mr(H2SO3) = 82,08.
Řešení:
Z jodometrického stanovení se zjistí obsah kyseliny siřičité. Stechiometrický
poměr reagujících složek (H 2SO 3 a I 2) je 1 : 1. Obsah kyseliny podle
(3)
bude
w(H2SO3) = 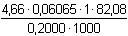 = 0,11599 .... 11,60 %
= 0,11599 .... 11,60 %
Obsah kyseliny sírové se zjistí z rozdílu celkového látkového množství hydroxidu a
hydroxidu spotřebovaného na kyselinu siřičitou. Alkalimetrická titrace kyseliny
siřičité na methylovou oranž probíhá do 1.stupně, takže
n(H2SO3) =
n(NaOH) · 1.
w(H2SO4) = 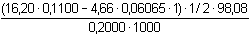 = 0,3676 .... 36,76 %
= 0,3676 .... 36,76 %
Vzorek obsahuje 11,60%(m/m) H2SO3 a 36,76%(m/m) H2SO4.
Zpět
|
|
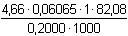 = 0,11599 .... 11,60 %
= 0,11599 .... 11,60 %
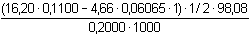 = 0,3676 .... 36,76 %
= 0,3676 .... 36,76 %