Řešení: αNi(NH3) = αY(H) = 1 a) a = 0
pNi = - log cNi = 2,00
b) a = 0,5 (přídavek 5,0 ml chelatonu)
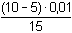 = 3,33·10-3
mol·l-1 = cNi/2 = 3,33·10-3
mol·l-1 = cNi/2
pNi = log 2 – log 6,67·10-3 = - log 3,33·10-3
= 2,48
c) a = 0,99 (přídavek 9,9 ml chelatonu)
pNi = 4,30
d) a = 1 (přídavek 10,0 ml chelatonu)
βNiY =
[Ni2+] = 3,544·10-11 mol·l-1
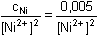 = 1018,60 = 1018,60pNi = 10,45
resp. podle
(20):
pNi = 1/2(log 1018,60 - log 10-2,30) = 10,45
e) a = 1,5 (přídavek 15,0 ml chelatonu)
cY = 15·0,01/25 = 0,006 mol·l-1 = 10-2,22
mol·l-1
[Y4-] = cY - cNi = 0,002 mol·l-1 =
10-2,70 mol·l-1
pNi = log (1018,60 · 10-2,70) - log 10-2,40 =
18,30
f) a = 2 (přídavek 20,0 ml chelatonu)
 [Ni2+] = β-1NiY
[Ni2+] = β-1NiY
podle
(22),
pNi = log βNiY = 18,60
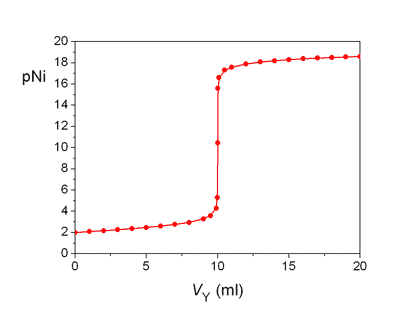
Grafické znázornění průběhu titrace 10 ml 0,01 M-Ni2+ odměrným roztokem 0,01 M-EDTA.
| ||