Řešení: a) Vytitrováno na 99,9%
Nevytitrováno zůstává 0,1% původního množství:
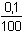 =
0,005 · 0,001 = 5·10-6 mol·l-1 =
0,005 · 0,001 = 5·10-6 mol·l-1
Konstanta stability komplexu je však velmi nízká a je třeba uvažovat jeho disociaci:
Koncentraci [M]dis vypočítáme řešením kvadratické rovnice (7) nebo (20a):
[M]celk. = [M]r + [M]dis = 5·10-6 +
7,02·10-5 = 7,52·10-5 mol·l-1
pM = 4,12
b) Nadbytek titrantu je 0,1%
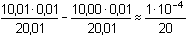 = 5·10-6 mol·l-1
= 5·10-6 mol·l-1
resp. [Y]r = cY ≈ 0,005 · 0,001 =
5·10-6 mol·l-1
V případě disociace komplexu platí: [Y]dis = [M]dis
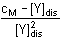
 [Y]2dis +
10-6[Y]dis - 10-6·0,005 = 0 [Y]2dis +
10-6[Y]dis - 10-6·0,005 = 0
[Y]dis = 7,02·10-5 mol·l-1
[Y]celk. = [Y]r + [Y]dis = 5·10-6 +
7,02·10-5 = 7,52·10-5 = 10-4,12
mol·l-1
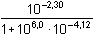 = 6,52·10-5
mol·l-1 = 10-4,18 mol·l-1 = 6,52·10-5
mol·l-1 = 10-4,18 mol·l-1
pM = log (106,0·10-4,12) - log 0,005 =
4,18
| ||