|
- Příklad 7.25




- Jaké pH bude mít nasycený roztok a) hydroxidu železitého, b) hydroxidu hořečnatého? Hydrolýzu
kationtů a disociaci vody neuvažujte!
Řešení Koncentraci OH– -iontů (resp. pOH) určuje rozpustnost příslušných hydroxidů. a) Ks(Fe(OH)3) = [Fe3+]·[OH–]3 = c·(3c)3 = 27 c4 = 3,72·10–40[Fe(OH)3] = c = 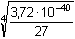 = 6,092·10–11 mol·l–1 = 6,092·10–11 mol·l–1[OH–] = 3 c = 1,828·10–10 mol·l–1 = 10–9,74 mol·l–1 pOH = 9,74  pH = 4,26 pH = 4,26 nebon(Fe3+) = n(OH–)·1/3Ks = ([OH–]·1/3)·[OH–]3 = 1/3[OH–]4 [OH–] = 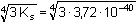 = 1,828·10–10 mol·l–1 = 10–9,74 mol·l–1 = 1,828·10–10 mol·l–1 = 10–9,74 mol·l–1pOH = 9,74  pH = 4,26 pH = 4,26 b) Ks(Mg(OH)2) = [Mg2+]·[OH–]2 = c·(2c)2 = 4 c3 = 1,12·10–11[Mg(OH)2] = c = 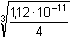 = 1,409·10–4 mol·l–1 = 1,409·10–4 mol·l–1[OH–] = 2 c = 2,818·10–4 mol·l–1 = 10–3,55 mol·l–1 pOH = 3,55  pH = 10,45 pH = 10,45 nebon(Mg2+) = n(OH–)·1/2Ks = ([OH–]·1/2)·[OH–]2 = 1/2·[OH–]3 [OH–] = 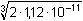 = 2,82·10–4 mol·l–1 = 10–3,55 mol·l–1 = 2,82·10–4 mol·l–1 = 10–3,55 mol·l–1pOH = 3,55  pH = 10,45 pH = 10,45 Zpět
|
|