Řešení: a) Prostředí 0,1M-KNO3 Řešení podle (14):
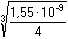 = -3,137 = -3,137
log [Ba(IO3)2] = -3,137 + 0,509·2·1·
[Ba(IO3)2] = 1,28·10-3
mol·l-1
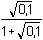 = -2,893 = -2,893Řešení podle (3):
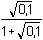 = -0,509·2·1·0,240 = -0,244
= -0,509·2·1·0,240 = -0,244  f± = 0,570
f± = 0,570
Ks,c =
[Ba(IO3)2] = 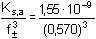 =
8,37·10-9 =
8,37·10-9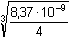 =
1,28·10-3 mol·l-1 =
1,28·10-3 mol·l-1
Rozpustnost jodičnanu barnatého v 0,1M-KNO3 je 1,28·10-3 mol·l-1 (bez ohledu na iontovou sílu roztoku je rozpustnost 7,29·10-4 mol·l-1, tj. asi 1,8krát nižší). b) Prostředí 0,03M-Ba(NO3)2
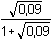 = -0,509·2·1·0,231 = -0,235
= -0,509·2·1·0,231 = -0,235  f± = 0,582
f± = 0,582
Řešení podle (14):
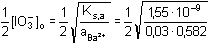
[Ba(IO3)2]o = 1,49·10-4
mol·l-1 = 10-3,827 mol·l-1
log [Ba(IO3)2] = -3,827 + 0,509·2·1·0,231 = -3,592
[Ba(IO3)2] = 2,56·10-4
mol·l-1
Řešení podle (3):
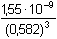 = 7,862·10-9 =
10-8,10 = 7,862·10-9 =
10-8,10
[Ba(IO3)2] = 2,56·10-4
mol·l-1
Rozpustnost jodičnanu barnatého v prostředí 0,03M-Ba(NO3)2 je 2,56·10-4 mol·l-1 (bez ohledu na iontovou sílu roztoku 1,49·10-4 mol·l-1). | ||