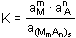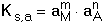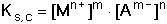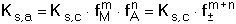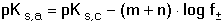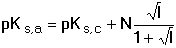| |||||
|
Při rozpouštění málo rozpustného elektrolytu ve vodě ustavuje se rovnováha mezi tuhou fází a hydratovanými ionty (MmAn)s
Rovnovážnou konstantu
lze upravit vhledem k jednotkové aktivitě tuhé fáze a konstanta K přejde na tvar označovaný jako součin rozpustnosti Ks látky MmAn Nahradíme-li aktivity iontů jejich rovnovážnými koncentracemi (u velmi málo rozpustných elektrolytů), získá se koncentrační hodnota součinu rozpustnosti Je-li v roztoku velká koncentrace iontů (iontová síla I > 0,001), vzájemné ovlivňování iontů je značné a součin rozpustnosti je třeba definovat pro dané experimentální podmínky. Pro zjednodušení se v praxi užívá záporného logaritmu hodnoty součinu rozpustnosti pKs = - log Ks resp. Hodnoty N pro jednotlivé rovnováhy jsou uvedeny v tabulce 9. | ||
| |||||

 (MmAn)r
(MmAn)r