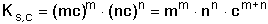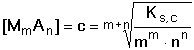|
7.1. Součin rozpustnosti a rozpustnost elektrolytů
Rozpustnost silného elektrolytu MmAn v nasyceném roztoku lze zjednodušeně
vyjádřit symbolem c, tedy [MmAn] = c. Koncentrace jednotlivých hydratovaných
iontů pak bude [Mn+] = mc a [Am-] = nc. Koncentrační součin rozpustnosti bude
definován
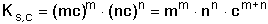 (6) (6)
Látková koncentrace (rozpustnost) sloučeniny v nasyceném roztoku se zjistí ze vztahu
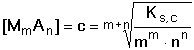 (7) (7)
Řešené příklady:
- Příklad 7.1

- Vypočtěte součin rozpustnosti fosforečnanu hořečnato-amonného! Při teplotě 25°C se
rozpustí 0,00344 g sloučeniny v objemu 400 ml vody. Mr = 137,31.
- Příklad 7.2

- Jaká je rozpustnost a) chloridu stříbrného, b) chromanu stříbrného v jejich nasycených
roztocích?
Ks(AgCl) = 1,8·10–10,
Ks(Ag2CrO4) = 2,45·10–12.
- Příklad 7.3

- Vypočtěte součin rozpustnosti hexachloroplatičitanu thalného, který se ve vodě rozpouští
v hmotnostním poměru 1:15585. Mr = 816,61.
- Příklad 7.4

- Jaká je látková a hmotnostní koncentrace jednotlivých složek v nasyceném roztoku fosforečnanu
olovnatého? Ks = 8·10-43;
Mr[Pb3(PO4)2] = 811,51; Mr(Pb) = 207,19;
Mr(PO4) = 94,97.
- Příklad 7.5

- Jaké množství vody je třeba k rozpuštění 1 g Ag3PO4? Ks =
1,45·10-16, Mr = 418,58.
- Příklad 7.6

- Jaká bude aktivitní hodnota součinu rozpustnosti chloridu olovnatého, jestliže při 15°C
se rozpustí 0,791 g látky ve 100 g (ml) vody na nasycený roztok? Mr = 278,10.
|
|