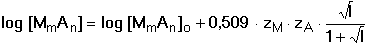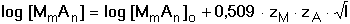| |||||
|
7.4. Vliv iontové síly roztoku na rozpustnost Ze vztahu (3) vyplývá, že hodnota součinu rozpustnosti je závislá na aktivitních koeficientech iontů, které tvoří sraženinu. U látek rozpustnějších je proto třeba uvažovat závislost hodnoty součinu rozpustnosti na iontové síle roztoku. Aktivita iontů, a tím i rozpustnost sloučeniny, je ovlivňována také přítomností iontů, které se srážecí rovnováhy přímo nezúčastní, avšak přispívají mnohdy výrazně ke zvýšení iontové síly roztoku. Spojením vztahů (3), (7) a Debye-Hückelovy rovnice lze závislost rozpustnosti sloučeniny MmAn na iontové síle roztoku vyjádřit vztahem resp.
kde [MmAn]o je rozpustnost sloučeniny ve velmi zředěném roztoku (I ≤ 1·10-4). Řešené příklady:
| ||
| |||||