



Řešení Rovnovážnou konstantu reakce Zn + Cu2+ Cu + Zn2+ lze vyjádřit s ohledem na jednotkovou koncentraci pevné fáze v roztoku následovně: Cu + Zn2+ lze vyjádřit s ohledem na jednotkovou koncentraci pevné fáze v roztoku následovně:
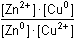 = log = log 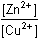
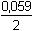 log [Zn2+] = E°Cu2+/Cu + log [Zn2+] = E°Cu2+/Cu + 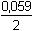 log [Cu2+] log [Cu2+]log Kr = log E°Cu2+/Cu = 0,337 V a E°Zn2+/Zn = -0,763 V (z tabulek)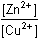 = = 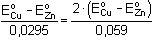 log Kr = 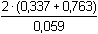 = 37,288 = 37,288  Kr = 1,94·1037 Kr = 1,94·1037 | ||