| |
| |
- Příklad 8.26




- Vypočítejte potenciál bodu ekvivalence při titraci a) arsenité soli roztokem soli ceričité,
b) 5 ml 0,01 molárního roztoku dichromanu roztokem 0,01M-Sn2+, c) soli ceričité
roztokem TiCl3. Předpokládejte, že [H3O+] =
1 mol·l-1 a aktivitní koeficienty jsou jednotkové.
Řešení b) Reakce probíhá podle základního schématu:Cr2O72– + 3 Sn2+ + 14 H+ → 2 Cr3+ + 3 Sn4+ + 7 H2O Vztah mezi látkovým množstvím (koncentracemi) reagujících složek a produktů vyjadřují následující rovnicen(Sn2+) = n(Cr2O72–)·3 n (Sn4+) = n(Cr3+)·3/2V bodě ekvivalence platí rovnost potenciálů, tedy Eekv = ECr = ESn6 Eekv. = 6 E°Cr + 0,059 log 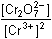 2 E ekv. = 2 E° Sn + 0,059 log 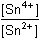 = 2 E° Sn + 0,059 log 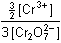
Po součtu obou rovnic a úpravě získáme výsledný vztah pro Eekv.:E ekv. = 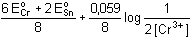 [Cr 3+] = 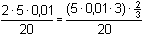 = 5·10 –3 mmol·ml –1 = mol·l –1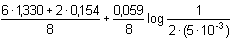 = 1,051 V = 1,051 V Zpět
|
| | |
|
|