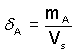|
1.1.2. Koncentrace
Koncentrace udává množství složky v objemu 1 dm3, resp. v 1 litru
a příslušných podílech.
a) Látková cA, c(A) - poměr látkového množství složky A
k celkovému objemu soustavy:
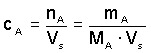 (9) (9)
Veličina MA je molární hmotnost [g·mol–1] složky A.
Je-li složení roztoku vyjádřeno hmotnostním zlomkem, lze látkovou koncentraci
vypočítat pomocí hustoty ze vztahu (10):
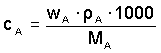 resp.
resp. 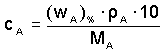 (10) (10)
Jednotka látkové koncentrace má rozměr [mol·dm–3], resp.
[mol·l–1] a symbol M. Např. roztok hydroxidu sodného o koncentraci
0,1 mol·dm–3 (0,1 mol·l–1) je možno zapsat jako 0,1 molární
nebo jako 0,1M-NaOH.
b) Hmotnostní δA, δ(A) - poměr
hmotnosti mA složky A k celkovému objemu soustavy:
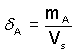 ... rozměr jednotky je [g·l–1], resp.
[kg·m–3] (11)
... rozměr jednotky je [g·l–1], resp.
[kg·m–3] (11)
- Pozn.:
- Mezinárodní nomenklaturou je termín "koncentrace" doporučen pouze
k označení množství složky v definovaném objemu, tzn. mol·dm–3
(mol·l–1), g·dm–3 (g·l–1), příp.
dm3·dm–3 (litr·litr–1),
mmol·ml–1, mmol·cm–3, nmol·ml–1 atp.
Řešené příklady:
- Příklad 1.9

- Jaká je koncentrace roztoku, který v objemu 500 ml obsahuje chlorid sodný
o hmotnosti 16,00 g?
Mr(NaCl) = 58,44.
- Příklad 1.10

- Jakou látkovou koncentraci bude mít roztok síranu železito-amonného,
jestliže 1 ml roztoku odpovídá 1,000 mg Fe2O3?
Mr(Fe2O3) = 159,70.
- Příklad 1.11

- Jaká hmotnost manganistanu draselného je obsažena v objemu 25 ml roztoku
o koncentraci
0,02 mol·l-1? Mr(KMnO4) = 158,342.
- Příklad 1.12

- Jaká je látková a hmotnostní koncentrace roztoku kyseliny dusičné, jehož
hmotnostní procentualita je 40? ρ40 = 1,252 g·cm-3,
Mr(HNO3) = 63,01.
- Příklad 1.13

- Kolik gramů síranu draselného je třeba k přípravě 250 ml 0,20 molárního
roztoku? Mr(K2SO4) = 174,26.
|
|

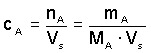
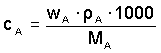
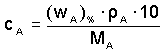 (10)
(10)