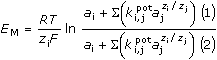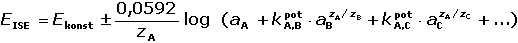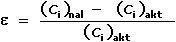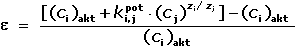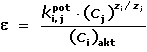|
IV.3. Membránový potenciál
Membránový potenciál EM vzniká na základě difúzních a iontově výměnných dějů, které
probíhají na rozhraní dvou elektrolytů oddělených membránou, nestejně propustnou pro přítomné ionty.
Krajními případy tohoto potenciálu jsou potenciál difúzní (kapalinový), je-li membrána propustná
pro všechny složky obou roztoků a potenciál Donnanův, jestliže membrána zcela zabrání difúzi z jednoho
roztoku do druhého alespoň jednoho druhu iontů. Mezi těmito extrémními případy se pohybují potenciály
reálných membrán. Membránový potenciál tedy představuje rozdílovou hodnotu potenciálů ΔE,
které se ustavují na obou stranách membrány: EM = E1 –
E2 = ΔE. Předpokládáme-li v obou roztocích (1)(2) ještě přítomnost
dalších iontů stejného znaménka a různých nábojů, lze pro rovnovážný potenciál EM odvodit
obecnou rovnici
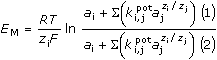
kde ki,jpot – koeficient selektivity je mírou selektivity
elektrody pro ion i s nábojem zi za přítomnosti iontu j
s nábojem zj. (hodnota koeficientu by měla být co nejmenší)
V praktickém uspořádání je jedna plocha membrány ve styku s vnitřním roztokem (2) konstantního složení,
takže potenciál iontově selektivní elektrody (ISE) je závislý pouze na složení vnějšího (měřeného)
roztoku (1) a je definován Nikolského rovnicí (při 25 °C):
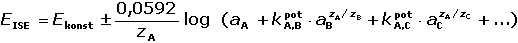 (IV.7) (IV.7)
kde Ekonst je stálý potenciál vnitřní části elektrody; znaménko plus
platí pro kationty, mínus pro anionty.
Vlivem interferujících iontů může docházet k chybným výsledkům měření. Lze je hodnotit jako
relativní chybu ε, resp. ε (%). Za předpokladu, že ai
= ci, relativní chyba bude představovat podíl rozdílu skutečné
(ci)akt a nalezené (ci)nal koncentrace
a skutečné koncentrace analytu (ci)akt:
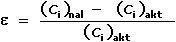 (IV.8) (IV.8)
Dosazením z rovnice (IV.7) vyplývá, že
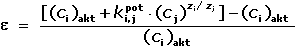 
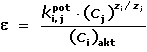 (IV.9) (IV.9)
Příklady
- Příklad IV.3.1




- Skleněná elektroda selektivní pro draselné ionty dává odezvu i na ionty cesné. O jakou hodnotu mV se
změní potenciál elektrody za nepřítomnosti iontů Cs+ a při jejich koncentraci 0,1
mol·l-1, je-li koncentrace K+-iontů 10-3 mol·l-1?
kK,Cspot = 10-1
Pozn.: do příslušných vztahů dosazujte koncentrace místo aktivit
- Příklad IV.3.2




- O jakou hodnotu se změní potenciál kadmiové ISE, budou-li v roztoku 0,02 mol·l-1
Cd2+-iontů přítomny také ionty olovnaté (0,005 mol·l-1) a kobaltnaté
(0,04 mol·l-1)? kCd,Pbpot = 7,3·10–1,
kCd,Copot = 1,6·10–4; (pozn.:
ai = ci)
- Příklad IV.3.3




- Odezva bromidové ISE je rušena přítomností jodidů. O jakou hodnotu mV se změní potenciál elektrody
za nepřítomnosti iontů I- a při jejich koncentraci 0,0001 mol·l-1,
je-li koncentrace Br--iontů 10-3 mol·l-1?
kBr,Ipot = 6·103, (pozn.:
ai = ci)
- Příklad IV.3.4




- Jaké bude přípustné množství interferujících iontů (I-, Cl-,
CO32-) při stanovení dusičnanů o koncentraci 0,005 mol·l-1
pomocí dusičnanové ISE, aby relativní chyba nepřestoupila 1% rel. (předpoklad ai
= ci)? kNO3,Ipot : I- = 10,
Cl- = 0,005, CO32- = 0,0002
- Příklad IV.3.5




- Vymezte oblast pH pro stanovení fluoridových iontů v rozmezí koncentrací od 0,1 mol·l-1
do 1·10-5 mol·l-1 fluoridovou ISE, aby chyba nepřestoupila 0,1% rel.
kF,OHpot = 0,1; předpoklad: ai = ci
- Příklad IV.3.6




- Při stanovení Ca2+-iontů vápníkovou ISE interferují ionty barnaté. Jaká je přípustná
koncentrace Ba2+-iontů, má-li při koncentraci vápenatých iontů 0,001 mol·l-1
být relativní chyba stanovení menší než 5%, resp. 1% ? kCa,Bapot =
3·10-4; (pozn.: ai = ci)
- Příklad IV.3.7




- Skleněná elektroda selektivní na sodné ionty dává odezvu i na ionty draselné. a) Jaká koncentrace
K+-iontů je přípustná, nemá-li při koncentraci Na+-iontů 1·10-4
mol·l-1 relativní chyba přesáhnout 3% ? b) Od které hodnoty pH lze tuto elektrodu
využít pro měření Na+-iontů, aby odchylka, způsobená aciditou, byla menší než 1 mV?
kNa,Kpot = 1·10-3,
kNa,Hpot = 1000
|
|