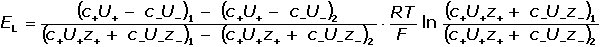|
IV.2. Difúzní (kapalinový) potenciál
Při spojení dvou poločlánků s elektrolyty různého složení nebo téhož elektrolytu různé koncentrace,
které se stýkají prostřednictvím propustné membrány, vzniká na rozhraní obou roztoků potenciální spád.
Příčinou jevu je nestejná rychlost difúze iontů, pohybujících se z míst vyšší koncentrace do míst o nižší
koncentraci, současně se uplatňují jejich rozdílné individuální pohyblivosti. Rozdíl potenciálů v přechodové
vrstvě se nazývá difúzní nebo kapalinový. Tento potenciál může zkreslit hodnotu měřené
veličiny, zejména u přímé potenciometrie, a je třeba jej potlačit na minimum. Toho se dosáhne přídavkem
indiferentního elektrolytu stejné a dostatečně velké koncentrace do obou poločlánků nebo lépe jejich
spojením pomocí solného můstku.
K výpočtu kapalinového potenciálu EL se nejčastěji používá Hendersonovy rovnice,
např. ve tvaru
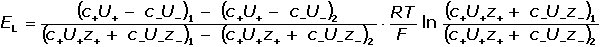 (IV.6) (IV.6)
kde ci jsou koncentrace iontů a Ui iontové pohyblivosti
v elektrolytech 1 a 2.
Místo iontových pohyblivostí Ui lze do rovnice (IV.6) dosadit molární vodivosti
λio při nekonečném zředění, neboť mezi oběma veličinami platí přímá úměrnost:
λio = |zi|FUi
Příklady
- Příklad IV.2.1




- Jaké je napětí stříbrného koncentračního článku při 25 °C, jestliže c1 =
10c2 a je-li a) článek bez převodu, b) Jak velkou hodnotu bude mít difúzní potenciál
v případě článku s převodem?
- Příklad IV.2.2




- Jaký je difusní potenciál koncentračního článku s převodem, jsou-li uni-univalentní elektrolyty 0,1
a 0,001 molární roztoky AgNO3? t = 25°C
- Příklad IV.2.3




- Jak velký je difúzní potenciál na rozhraní vody (pH = 7) a 3 molárního roztoku KCl (25 °C)?
- Příklad IV.2.4




- Jakou hodnotu bude mít difúzní potenciál na rozhraní mezi 0,02 molárními roztoky hydroxidu draselného
a chloridu sodného při 25 °C?
- Příklad IV.2.5




- Při měření pH roztoku kyseliny chlorovodíkové o koncentraci a) 1 mol·l-1
a b) 10-5 mol·l-1 skleněnou elektrodou byla použita kalomelová referentní
elektroda c) 0,1 molární a d) 3,5 molární (při 25 °C). Kolik milivoltů má v jednotlivých případech
difúzní potenciál a jakou změnu pH tento potenciál představuje za předpokladu, že teoretická směrnice
je 59,2 mV/pH?
- Příklad IV.2.6




- Jaký bude potenciál na rozhraní dvou roztoků kyseliny chlorovodíkové (c1 =
0,1 mol·l-1, c2 = 0,01 mol·l-1) a jaký bude
potenciálový rozdíl po spojení poločlánků solným můstkem naplněným roztokem KCl o koncentraci
4 mol·l-1 (při 25 °C)?
|
|