| |
| |
IV.1. Výpočty rovnovážných napětí (Ue) článků
- Příklad IV.1.1




- Určete elektromotorické napětí Ue a póly článku složeného z vodíkové elektrody,
sycené vodíkem za parciálního tlaku 99,325 kPa, a z argentochloridové elektrody. Obě elektrody
jsou ponořeny do roztoku přesně 0,1 molární HCl (f± = 0,796); tenze vodní páry
pH2O = 3,33 kPa, t = 25°C.
- Příklad IV.1.2




- Určete elektromotorické napětí Ue a póly článku složeného ze dvou vodíkových
elektrod, z nichž jedna je ponořena do roztoku o pH 3,00 a druhá do roztoku o pH 8. Obě elektrody
jsou syceny vodíkem za parciálního tlaku 101,325 kPa, t = 25 °C.
- Příklad IV.1.3




- Určete Ue a póly článku složeného z indikační stříbrné elektrody a referentní
nasycené kalomelové elektrody (SKE) v bodě ekvivalence při titraci NaCl dusičnanem stříbrným.
ESKE = 0,241 V, t = 25 °C,
Ks(AgCl) = 1,8·10–10
- Příklad IV.1.4




- Jaké EMN při titraci bromidů dusičnanem stříbrným bude v bodě ekvivalence vykazovat článek
(t = 25 °C) složený ze stříbrné a 0,1 molární kalomelové elektrody? pKs(AgBr) = 12,31;
aktivitní koeficient pro 0,1M-KCl je f± = 0,769
- Příklad IV.1.5




- Určete elektromotorické napětí Ue a póly článku složeného z argentochloridové
a platinové elektrody ponořené do roztoku, ve kterém bylo 40% cínaté soli zoxidováno na sůl cíničitou,
t = 25 °C, aktivita chloridových iontů je aCl– = 0,01 mol·l–1
- Příklad IV.1.6




- Vypočtěte EMN článku složeného a) z 0,01 molární kalomelové, b) z nasycené kalomelové elektrody
(EoSKE = 0,241 V) a stříbrné indikační elektrody ponořených do roztoku
0,05M-KI, který byl z 95% vytitrován dusičnanem stříbrným! Ks(AgI) = 8,3·10–17
- Příklad IV.1.7




- Poločlánek (Zn-elektroda v roztoku ZnCl2) je elektrolytickým mostem spojen s druhým
poločlánkem (Ag-elektroda v roztoku AgNO3). Jaké bude napětí Ue
uvedeného článku?
- Příklad IV.1.8




- Jaké bude napětí Ue uvedeného článku, vytvořeného dvěma kovovými elektrodami
(Zn a Ag), ponořenými do roztoků Zn2+- a Ag+-iontů, oddělených solným mostem?
Zn | Zn(NO3)2 (0,5 mol/l; f = 0,49) || Pb(NO3)2 (1 mol/l, f = 0,112) | Pb
- Příklad IV.1.9




- Jaké bude napětí Ue článku, jehož redoxní poločlánek tvoří Pt-elektroda v roztoku
směsi 0,01M-Fe2+ a 0,05M-Fe3+. Referentní elektroda je 0,1 molární argentochloridová.
- Příklad IV.1.10




- Jaký bude rovnovážný potenciál argentochloridové elektrody v roztoku 0,0500M-HCl
(f± = 0,830) vzhledem k vodíkové elektrodě, sycené vodíkem při atmosférickém
tlaku 99,58 kPa, teplotě 25 °C a tensi vodních páry 3,11 kPa.
- Příklad IV.1.11




- Jaký formální potenciál má Pt-elektroda v roztoku bromičnanu a bromidu při pH 8?
[BrO3–] = [Br–], elektrodová reakce: BrO3–
+ 3H2O + 6e
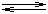 Br– + 6OH– Br– + 6OH–
- Příklad IV.1.12




- Jaký formální potenciál má Pt-elektroda v roztoku bromičnanu a bromidu při pH 2?
[BrO3–] = [Br–], elektrodová reakce: BrO3–
+ 6H+ + 6e
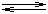 Br– + 6H2O Br– + 6H2O
- Příklad IV.1.13




- Jaký potenciál má indikační Pt-elektroda v roztoku o pH = 2 (25 °C), který v objemu 100 ml roztoku
obsahuje 0,5 g K2CrO4 a 0,15 g CrCl3·H2O?
|
| | |
|
|