



ŘešeníChroman je v kyselém prostředí nestálý a rovnováha se posouvá ve prospěch dichromanu 2 CrO42- + 2 H+ → Cr2O72- + H2O Výpočet rovnovážných koncentrací složek: [Cr2O72-] = ½ c(K2CrO4) = ½ · [Cr3+] = Mechanismus elektrodové redoxní reakce v kyselém prostředí: Cr2O72- + 6e + 14 H+ → 2 Cr3+ + 7 H2O Potenciál Pt-elektrody v daném systému bude definován korigovanou rovnicí (IV.5), Eo = 1,330 V (z tab. 1): E = Eo + E = 1,330 - 14 · | ||
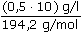 = 0,0129 mol·l-1
= 0,0129 mol·l-1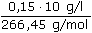 = 0,0056 mol·l-1
= 0,0056 mol·l-1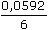 log
log 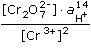 = Ef +
= Ef + 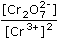
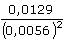 =
=