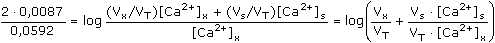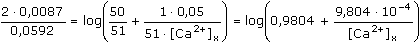- Příklad IV.4.18




- Koncentrace Ca2+-iontů ve vzorku vody byla stanovena metodou přídavku standardu pomocí
systému elektrod ISE – AgCl/Ag. Do 100 ml odměrné baňky bylo odměřeno 10 ml vzorku vody a roztok
byl doplněn destilovanou vodou na definovaný objem. Přesně polovina objemu baňky byla přenesena
do měrné nádobky a změřen potenciál článku Ue = –0,0529 V. Pak byl přidán 1 ml
standardu koncentrace 0,05 mol·l-1 a nově změřený potenciál měl hodnotu –0,0442 V.
Jaká je koncentrace Ca2+-iontů ve vzorku vody?
ŘešeníJak vyplývá z rovnice (IV.1) a rovnice Nernstovy (IV.2), potenciál článku se vzorkem bude definován vztahem Ue1 = -0,0529 = Eofind +  log [Ca2+]x - Eref log [Ca2+]x - Eref Potenciál vzorku s přídavkem standardu: Ue2 = -0,0442 = Eofind +  log log 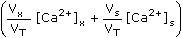 - Eref - Eref kde VT je celkový objem (Vx + Vs) po přídavku standardu. Odečtením první rovnice Ue1 od druhé Ue2 se získá vztah ΔUe = 0,0087 = 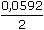 log log 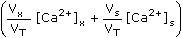 - - 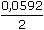 log log [Ca2+]x log log [Ca2+]x 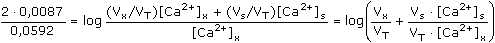
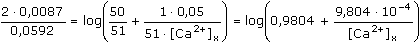
Odtud výsledek: [Ca2+]x = 9,932·10-4 mol·l-1 Zpět
| 



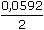 log [Ca2+]x - Eref
log [Ca2+]x - Eref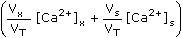 - Eref
- Eref