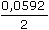ŘešeníVýpočet hodnot ΔE1/2 = (E1/2)vol – (E1/2)k pro dané koncentrace ligandu:
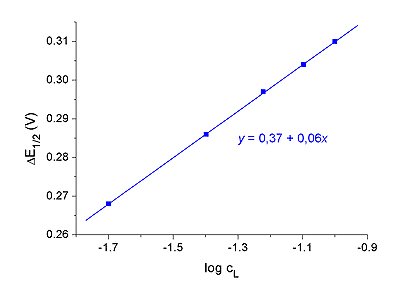
a) Řešení podle rovnice (VII.27): ΔE1/2 = 0,268 = 0,0296 log βp + p · 0,0296 log 0,02 | ·(-1) 0,310 = 0,0296 log βp + p · 0,0296 log 0,10 0,042 = p (0,0503 – 0,0296) = p · 0,0203 Výsledky p z dalších souborů rovnic: 2,03; 1,97; 2,07; 2,02; 2,02; 1,89; 2,04; 2,08; 2,02 Průměr 10 hodnot: p10 = 2,02 ≈ 2 ligandy Poměr centrálního kovového iontu a ligandu je 1:2 Konstanta stability β2: 0,310 = 0,0296 log β2 + 2 · 0,0296 log 0,10 log β2 = 12,473 Pozn.: Použije-li se p = 2,03, vyjde log β2 = 12,503 a β2 = 3,18·1012 b) Řešení pomocí regresní přímky pro funkci: ΔE1/2 = f (log cL) ΔE1/2 = Graf závislosti ΔE1/2 = f(log cL):
Rovnice regresní přímky má tvar y = 0,37 + 0,06 x ΔE1/2 = 0,37 + 0,06 log cL Ze směrnice regresní přímky lze vypočítat počet ligandů p v komplexu: 0,06 = p Úsek regresní přímky umožňuje vypočet konstanty stability β2: 0,37 = | ||||||||||||||||||||||||||||||||
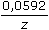 log βp + p
log βp + p  p = 2,03 ≈
p = 2,03 ≈