|
- Příklad VIII.1.25




- Vypočítejte rozpustnost AgCl, je-li specifická vodivost κ (při 25 °C) nasyceného
roztoku 3,46·10–6 S·cm–1 a čisté vody 1,68·10–6
S·cm–1. Mr(AgCl) = 134,34
ŘešeníNasycené roztoky málo rozpustných solí jsou prakticky úplně disociovány, takže jejich molární vodivost dosahuje hodnoty Λo. Λo = λo(Ag+) + λo(Cl-) = 61,90 + 76,35 = 138,25 S·cm2·mol–1 [AgCl] = c = 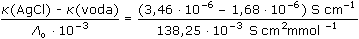 = 1,29·10-5 mmol·cm-3 = mol·dm-3 = 1,29·10-5 mmol·cm-3 = mol·dm-3  1,733 mg·l-1 1,733 mg·l-1 resp. c = 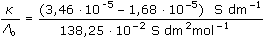 = 1,29·10-5 mol·dm-3 = 1,29·10-5 mol·dm-3 resp. c = 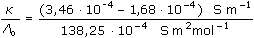 = 0,0129 mol·m-3 = 0,0129 mol·m-3 Správnější výsledek pro vodivost uni-univalentních elektrolytů koncentrace c < 0,001 mol/l se získá využitím Debye-Hückel-Onsangerovy rovnice Λ = Λo - (A + B · Λo) · 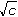 , , kde číselné konstanty mají hodnotu (pro 25 °C) A = 60,65 a B = 0,230. Λ = 138,25 – (60,65 + 0,230·138,25)·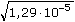 = 137,92 S·cm2·mol–1 = 137,92 S·cm2·mol–1 [AgCl] = c = 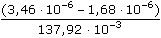 = 1,29·10-5 mol·l-1 = 1,29·10-5 mol·l-1 Výsledek se v tomto případě neliší od předchozího přibližného postupu. Zpět
|
|