| |
| |
- Příklad 3.103




- Vzorek směsi HVO3 a H2MoO4 hmotnosti 0,5965 g byl
redukován oxidem siřičitým v prostředí kyseliny sírové (HVO3
→ VO2+). Při reoxidaci se spotřebovalo 5,24 ml
0,03004M-KMnO4. Nová navážka směsi hmotnosti 0,5254 g byla redukována na
reduktoru (HVO3 → V2+,
H2MoO4 → Mo3+) a vzniklé
produkty byly reoxidovány železitou solí za přítomnosti kyseliny fosforečné. Vytvořená
železnatá sůl byla ztitrována 18,28 ml 0,03004M-KMnO4. Jaký je hmotnostní
obsah kyselin ve vzorku?
Řešení Hmotnostní obsah HVO3, řešení podle (3):w(HVO3) = 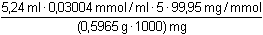 = 0,13188, tj. 13,19 % = 0,13188, tj. 13,19 % Hmotnostní obsah H2MoO4:n(H2MoO4) = n(Fe2+) · 1/3 n(Fe2+) = n(KMnO4) · 5n(H2MoO4) = n(KMnO4) · 5/3 V důsledku jiné navážky vzorku je třeba vypočítat objem, resp. látkové množství KMnO4, který by se spotřeboval na oxidaci VO2+:VKMnO4 = 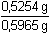 · 5,24 ml = 4,615 ml · 5,24 ml = 4,615 ml Redukcí reduktorem a následnou reoxidací železitými ionty však vznikne vlivem V(II) množství Fe2+-iontů, které odpovídá trojnásobku spotřeby manganistanu oproti mírné redukci oxidem siřičitým:w(H2MoO4) = 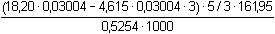 = 0,0672, tj. 6,72 % = 0,0672, tj. 6,72 % Zpět
|
| | |
|
|




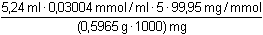 = 0,13188, tj. 13,19 %
= 0,13188, tj. 13,19 %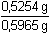 · 5,24 ml = 4,615 ml
· 5,24 ml = 4,615 ml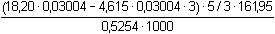 = 0,0672, tj. 6,72 %
= 0,0672, tj. 6,72 %