|
- Příklad 3.105




- Hliník přítomný ve vzorku slitiny byl vyizolován jako 8-hydroxychinolinát hlinitý.
Po rozpuštění sraženiny v kyselině chlorovodíkové byla organická složka stanovena
bromometricky za přítomnosti bromidu draselného. Jaký je hmotnostní obsah hliníku
ve slitině, jestliže na 0,2700 g vzorku se spotřebovalo 8,07 ml 0,0125M-KBrO3?
Řešení Základní reakční mechanismus:Al3+ + 3 C9H6N-OH → Al(C9H6N-O)3 + 3 H+ 8-hydroxychinolinC9H6N(OH) + 2 Br2 → C9H4N(OH)(Br)2 + 2 HBr |·3 5,7-dibrom-8-hydroxychinolinBrO3– + 5 Br– + 6 H+ → 3 Br2 + 3 H2O |·2
Pro rovnost látkových množství reagentů platí následující vztahy (pozn.: 8-hydroxychinolin = oxin):n(Al3+) = n(oxin) · 1/3 n(oxin) = n(Br2) · 1/2 n(Br2) = n(KBrO3) · 3n(Al3+) = n(KBrO3) · 1/2 Hmotnostní obsah hliníku se vypočítá podle rovnice (3):w(Al) = 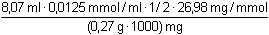 = 0,00504, tj. 0,50 % = 0,00504, tj. 0,50 % Zpět
|
|




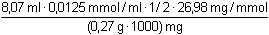 = 0,00504, tj. 0,50 %
= 0,00504, tj. 0,50 %