|
- Příklad 3.81
- Vzorek směsi H2SO4, SO3 a SO2 má hmotnost 1 g.
Při alkalimetrické titraci na fenolftalein se spotřebovalo 23,40 ml 1,0505M-NaOH.
Při jodometrickém stanovení téže navážky směsi se spotřebuje 4,70 ml 0,0511M-I2.
Jaký je procentový obsah jednotlivých složek ve vzorku ?
Mr(H2SO4) = 98,08; Mr(SO3) = 80,06;
Mr(SO2)= 64,06.
Řešení:
Z jodometrické titrace se určí obsah SO2:
m(SO2) = 4,70 · 0,0511 · 1 · 64,06 = 15,4 mg
w(SO2) = 0,0154 .... 1,54 %
Při alkalimetrické titraci na fenolftalein reagují s alkalickým hydroxidem všechny
složky do 2.stupně. Pro výpočet obsahu zbývajících dvou složek je proto třeba
odečíst objem hydroxidu spotřebovaný na oxid siřičitý.
n(NaOH) = n(SO2) · 2
Podle (4)
V(NaOH) · 1,0505 = 4,70 · 0,0511 · 2
V(NaOH) = 0,457 ml
Spotřeba hydroxidu na směs H2SO4 a SO3 bude tedy:
23,40 – 0,457 = 22,943 ml.
Označíme-li m 1 a m 2 hmotnost H 2SO 4 a SO 3,
pak podle (1)
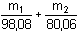 = 22,943 · 1,0505 · 1/2 mmol NaOH = 22,943 · 1,0505 · 1/2 mmol NaOH
m1 + m2 = 1000 – 15,4 = 984,6 mg
Řešením této soustavy dvou rovnic o dvou neznámých se získají hodnoty
m1 = 107,83 mg = 0,10783 g H2SO4
w1 = 10,78 %
m2 = 876,77 mg = 0,87677 g SO3
w2 = 87,68 %
Vzorek směsi obsahuje 10,78%(m/m) H2SO4, 87,68%(m/m) SO3 a 1,54%(m/m) SO2.
Zpět
| | |
| |
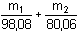 = 22,943 · 1,0505 · 1/2 mmol NaOH
= 22,943 · 1,0505 · 1/2 mmol NaOH