| |
| |
- Příklad 5.105




- Jaké pH má roztok hydrazin-hydrochloridu koncentrace 0,01 mol·l-1?
Řešení Tabelovaná kyselostní konstanta hydrazinia a odpovídající konstanta basicity:pKBH+ = 7,99 pKB = 6,01 Výpočet pH podle (61):pH = 1/2(pKw - pKB - log cBH+) = 1/2(pKBH+ - log cBH+) pH = 1/2(14 – 6,01 – log 0,01) = 1/2(7,99 – log 0,01) = 4,995 ≈ 5,00 Výpočet podle (59) a (60):γ = 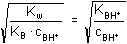 γ = 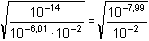 -2,995 = 1,01·10 -3 pH = – log (cBH+ · γ) = – log (0,01 · 1,01·10–3) = 4,995 ≈ 5,00Zpět
|
| | |
|
|
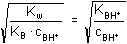
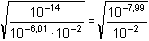 -2,995 = 1,01·10-3
-2,995 = 1,01·10-3