|
- Příklad 5.118




- Vypočtěte pH směsi 20 ml 0,05 molárního ethylendiaminu a 40 ml 0,025M-HCl !
Řešení Tabelované konstanty ethylendiamonia, resp. ethylendiaminu:pKa1 = pKBH22+ = 7,18 pKB2 = pKw – 7,18 = 6,82pKa2 = pKBH+ = 9,96 pKB1 = pKw – 9,96 = 4,04 (H3N–CH2–CH2–NH3)2+ 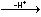 (H3N–CH2–CH2–NH2)+ (H3N–CH2–CH2–NH2)+ 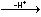 H2N–CH2–CH2–NH2 H2N–CH2–CH2–NH2 Látková množství reagujících složek:nen = 20·0,05 = 1 mmolnHCl = 40·0,025 = 1 mmol Protože nen = nHCl, lze předpokládat, že v ethylendiaminu je protonizována jedna aminoskupina. Produktem je Hen+.a) Hodnotu pH lze vypočítat podle vztahu (74a): pOH = 1/2(pKB1 + pKB2) = 1/2(4,04 + 6,82) = 5,43  pH = 14 – 5,43 = 8,57 pH = 14 – 5,43 = 8,57nebo podle (74b) pH = 1/2(pKa1 + pKa2) = 1/2(7,18 + 9,96) = 8,57 b) Vliv iontové síly roztoku, tvoří ji ionty Hen+ a Cl–: I = 0,0167 pKw,c = 14 – 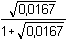 = 14 – 0,144 = 13,886 = 14 – 0,144 = 13,886pKB1 = 4,04 – 0,114 = 3,926 pKa2 = 13,886 – 3,926 = 9,960 pKB2 = 6,82 – 2 · 0,114 = 6,592 pKa1 = 13,886 – 6,592 = 7,294Podle (74a): pH = 13,886 – 1/2(3,926 + 6,592) = 8,63 Podle (74b): pH = 1/2(7,294 + 9,960) = 8,63 Zpět
|
|
 pH = 14 – 5,43 = 8,57
pH = 14 – 5,43 = 8,57



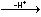 (H3N–CH2–CH2–NH2)+
(H3N–CH2–CH2–NH2)+ 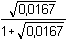 = 14 – 0,144 = 13,886
= 14 – 0,144 = 13,886