|
- Příklad 5.134




- Určete pH následujících boritanových pufrů, včetně s ohledem na iontovou sílu roztoků:
a) 0,01M-Na2B4O7;
b) 100 ml 0,01M-Na2B4O7 + 100 ml 0,01M-H3BO3;
c) 100 ml 0,01M-Na2B4O7 + 100 ml 0,01M-NaOH;
d) 100 ml 0,01M-Na2B4O7 + 100 ml 0,01M-HCl.
Řešení Hydrolýza boraxu probíhá podle rovnice:B4O72– + 5 H2O → 2 H3BO3 + 2 H2BO3– a) Poměr vzniklé kyseliny borité a její konjugované zásady je 1:1. Podle (76): pH = pK HA + log 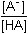 = pK HA = 9,237 ≈ 9,24pH = 9,237 – 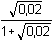 = 9,237 – 0,124 = 9,113 ≈ 9,11 = 9,237 – 0,124 = 9,113 ≈ 9,11 b) Přídavek 100 ml 0,01M-H3BO3: Podle (76): pH = 9,237 + log 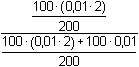 pH = 9,237 + log 2/3 = 9,237 – 0,176 = 9,061 ≈ 9,06 Iontová síla roztoku: I = 0,01 pH = (9,237 – 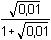 ) + log 2/3 = 9,146 – 0,176 = 8,97 ) + log 2/3 = 9,146 – 0,176 = 8,97 c) Přídavek silného hydroxidu částečně zneutralizuje kyselinu boritou, vzniká boritan. K řešení použijeme vztah (76), lze počítat s látkovým množstvím složek.pH = 9,237 + log 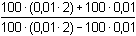 = 9,237 + log 3 = 9,71 = 9,237 + log 3 = 9,71 Iontová síla roztoku je tvořena boritanem a ionty Na+: I = 0,015pH = (9,237 – 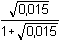 ) + log 3 = 9,128 + 0,477 = 9,605 ≈ 9,60 ) + log 3 = 9,128 + 0,477 = 9,605 ≈ 9,60 d) d) Přídavek silné kyseliny částečně zneutralizuje boritan, vzniká kyselina boritá. Řešení podle (76), lze počítat s látkovým množstvím hlavních složek pufru.pH = 9,237 + log 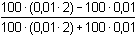 = 9,237 - log 3 = 8,76 = 9,237 - log 3 = 8,76 Iontovou sílu roztoku tvoří ionty boritanové, sodné a chloridové: I = 0,01pH = (9,237 – 0,091) – log 3 = 9,146 – 0,477 = 8,67 Zpět
|
|




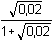 = 9,237 – 0,124 = 9,113 ≈ 9,11
= 9,237 – 0,124 = 9,113 ≈ 9,11 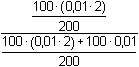
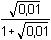 ) + log 2/3 = 9,146 – 0,176 = 8,97
) + log 2/3 = 9,146 – 0,176 = 8,97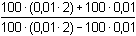 = 9,237 + log 3 = 9,71
= 9,237 + log 3 = 9,71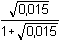 ) + log 3 = 9,128 + 0,477 = 9,605 ≈ 9,60
) + log 3 = 9,128 + 0,477 = 9,605 ≈ 9,60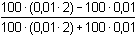 = 9,237 - log 3 = 8,76
= 9,237 - log 3 = 8,76 = pKHA = 9,237 ≈
= pKHA = 9,237 ≈