| |
| |
- Příklad 5.136




- Vypočtěte pH roztoku vzniklého smísením 5 ml 0,05 molárního tetraboritanu sodného a 5 ml
0,1M-NaOH!
Řešení Hydrolýza boraxu probíhá podle rovnice:B4O72– + 5 H2O → 2 H3BO3 + 2 H2BO3– n(H3BO3) = 5 · (0,05·2) = 0,5 mmoln(NaOH) = 5 · 0,1 = 0,5 mmol
Z látkových množství reagujících složek vyplývá, že veškerá kyselina boritá v boraxovém pufru byla zneutralizována, a tedy roztok již obsahuje pouze anion slabé kyseliny (boritan).Koncentrace aniontu: c(H2BO3–) = 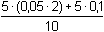 = 0,1 mmol·ml–1 = mol·l–1 = 0,1 mmol·ml–1 = mol·l–1 pH boritanu (podle (55)):pH = 1/2(pKw + pKHA + log cA–)pH = 1/2(14,00 + 9,237 + log 0,1) = 11,12 Iontovou sílu roztoku tvoří boritanové a sodné ionty: I = 0,1pH = 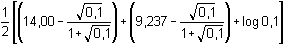 = 10,88 = 10,88 Zpět
|
| | |
|
|




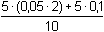 = 0,1 mmol·ml–1 = mol·l–1
= 0,1 mmol·ml–1 = mol·l–1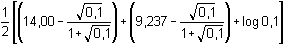 = 10,88
= 10,88