| |
| |
- Příklad 5.137




- Základní roztok "citranu" pro přípravu tlumivých roztoků obsahuje 0,1
mol·l-1 kyseliny citronové a 0,2 mol·l-1 NaOH. Jaké budou
mít roztoky pH, jestliže se smísí:
a) 4 ml "citranu" a 6 ml 0,1M-HCl,
b) 6 ml "citranu" a 4 ml 0,1M-HCl,
c) 8 ml "citranu" a 2 ml 0,1M-NaOH ?
Uvažujte také vliv iontové síly roztoků!
Řešení Tabelované hodnoty disociačních konstant kyseliny citronové: pK1 = 3,128; pK2 = 4,761; pK3 = 6,396 H3A 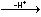 H2A– H2A– 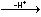 HA2– HA2– 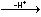 A3– A3–
Základní roztok "citranu" byl připraven částečnou neutralizací trojsytné kyseliny do 2.stupně (HA2–):n(NaOH) = n(H3A) · 2  n(HA2–) = n(H3A) = 0,1 mol v litru "citranu" n(HA2–) = n(H3A) = 0,1 mol v litru "citranu" a) Smíchány byly 4 ml 0,1M-"citranu" (HA2–) a 6 ml 0,1M-HCl:n(HA2–) = 4 · 0,1 = 0,4 mmol n(HCl) = 6 · 0,1 = 0,6 mmol HA2– 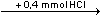 H2A– H2A– 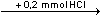 H3A H3A0,4 mmol 0,4 mmol 0,2 mmol Roztok obsahuje 0,2 mmol H2A– a 0,2 mmol H3A
Protože látková množství (resp. koncentrace) obou složek jsou stejná, hodnota pH podle (76) bude:pH = pK1 = 3,13 Iontová síla roztoku je tvořena ionty Na+, H2A– a Cl–:I = 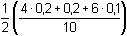 = 0,08 = 0,08pH = pK1,c = 3,13 – 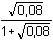 = 2,91 = 2,91 b) Směs 6 ml 0,1M-"citranu" (HA2–) a 4 ml 0,1M-HCl:pH = pK2 + log 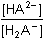 = 4,761 + log = 4,761 + log 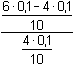 = 4,46 = 4,46 Iontovou sílu roztoku tvoří ionty Na+, Cl- a oba citranové anionty:I = 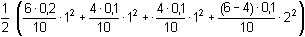 = 0,14 = 0,14pH = 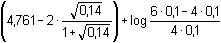 = 3,92 = 3,92 c) Směs 8 ml 0,1M-"citranu" (HA2–) a 2ml 0,1M-NaOH:pH = pK3 + log 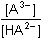 = 6,396 + log = 6,396 + log 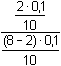 = 5,92 = 5,92 Iontovou sílu roztoku tvoří ionty Na+ (z citranu a NaOH) a oba citranové anionty:I = 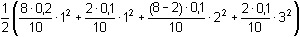 = 0,30 = 0,30pH = 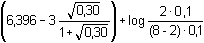 = 4,85 = 4,85 Zpět
|
| | |
|
|




 H2A–
H2A– 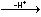 HA2–
HA2– 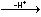 A3–
A3– n(HA2–) = n(H3A) = 0,1 mol v litru "citranu"
n(HA2–) = n(H3A) = 0,1 mol v litru "citranu"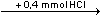 H2A–
H2A– 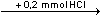 H3A
H3A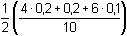 = 0,08
= 0,08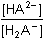 = 4,761 + log
= 4,761 + log 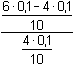 = 4,46
= 4,46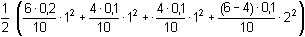 = 0,14
= 0,14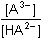 = 6,396 + log
= 6,396 + log 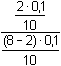 = 5,92
= 5,92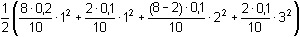 = 0,30
= 0,30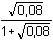 =
= 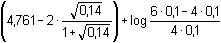 =
= 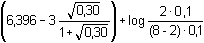 =
=